Гемофильная инфекция
Hib может вызывать ряд клинических синдромов, включая [7]:
Гемофильная инфекция
 Версия: Клинические протоколы КР 2022 (Кыргызстан)
Версия: Клинические протоколы КР 2022 (Кыргызстан)
Общая информация
Краткое описание
КЛИНИЧЕСКОЕ РУКОВОДСТВО
Гемофильная инфекция (Hib-инфекция) – распространенное заболевание человека, передающееся воздушно-капельным и контактным путем, сопровождающееся развитием бактериального менингита у детей, пневмонии и других серьезных инфекций. [1]
Кодирование по МКБ-10
Код
Название
А41.3
Септицемия, вызванная Haemophilus influenzae
А49.2
Инфекция, вызванная Haemophilus influenzae, неуточненная
В96.3
Haemophilus influenzae, как причина болезней, классифицированных в других рубриках
J14
Пневмония,вызванная Haemophilus influenzae (палочкой Афанасьева -Пфейффера)
J20.1
Острый бронхит, вызванный Haemophilus influenzae (палочкой Афанасьева - Пфейффера)
Классификация
Клинические формы гемофильной инфекции
Возрастная группа
Штаммы
Сепсис
Новорожденные, роженицы
Дети и взрослые
Этиология и патогенез
Этиология
Haemophilus influenzae - это плеоморфные грамотрицательные палочки, которые обычно колонизируют и заражают дыхательные пути человека. Виды H. influenzae делятся на типируемые (инкапсулированные) и нетипируемые (капсулированные) штаммы.
Среди типируемых штаммов H. influenzae серотипа b (Hib) является наиболее вирулентным. В регионах мира, где вакцинация против Hib не получила широкого распространения, Hib является ведущей причиной менингита и эпиглоттита у детей и пневмонии у взрослых. Напротив, в районах, где вакцинация является установленной, распространенность Hib снизилась, а экологическая ниша для нетипируемого H. influenzae выросла.
Нетипируемые штаммы, как правило, менее вирулентны, чем Hib, и чаще всего вызывают инфекции слизистой оболочки дыхательных путей, включая средний отит, острый риносинусит, острый бронхит, острые обострения хронической обструктивной болезни легких и пневмонию.
Патогенез
Колонизация слизистой оболочки дыхательных путей является первым шагом в патогенезе большинства инфекций, вызываемых типируемыми и нетипируемыми H. influenzae. Наружная мембрана H. influenzae содержит несколько адгезинов, которые опосредуют прикрепление к эпителию дыхательных путей, включая пили, фимбрии, высокомолекулярные факторы (HMW1 и HMW2) и Hia (гомологичны гемагглютинину коклюша). Липопротеины бактериальной клеточной стенки (включая липоолигосахарид [LOS]) нарушают функцию ресничек, препятствуя выведению H. influenzae из дыхательных путей, а также вызывают местное воспаление.
Колонизация - это динамический процесс, при котором новые штаммы регулярно проходят через слизистую оболочку дыхательных путей [2]. В некоторых случаях внедрение одного нового штамма может быть достаточно, чтобы вызвать симптоматическую инфекцию дыхательных путей (например, простуду у ребенка или обострение хронической обструктивной болезни легких у взрослого).
Другие инфекции, такие как острый средний отит или риносинусит, возникают в результате прямого распространения через слизистую оболочку дыхательных путей в новые участки.
Прямому распространению, вероятно, способствует высокая плотность колонизирующих бактерий в сочетании с их способностью образовывать биопленки.
• Инфекция слизистой оболочки. Инфекция на поверхности слизистой оболочки дополнительно усиливается за счет бактериальной продукции протеаз иммуноглобулина (Ig) A, которые расщепляют IgA в его стержневой области, тем самым ингибируя агглютинацию, связывание бактерий и опсонизацию [22-24]. Нетипируемые штаммы также ускользают от иммунной системы, выживая внутриклеточно в респираторных эпителиальных клетках и макрофагах, обеспечивая место для постоянной колонизации.
• Инвазивная инфекция. Инвазия тканей также является критическим патогенетическим признаком. Инвазивное заболевание относится к инфекции, которая распространяется за пределы дыхательных путей. Инвазивные клинические синдромы, вызываемые H. influenzae, включают менингит, бактериемию, эпиглоттит, септический артрит, целлюлит, гнойный перикардит, эндокардит и остеомиелит [25].
Большинство инвазивных инфекций вызываются H. influenzae типа b (Hib). Капсула типа b содержит полирибитол-рибозофосфат, мощный фактор вирулентности, который делает возможной инвазию в местные ткани, кровоток и, в некоторых случаях, центральную нервную систему [21,26]. Другие капсульные серотипы имеют другую схему гликозилирования и реже вызывают инвазивное заболевание по сравнению с Hib. Нетипируемые штаммы менее инвазивны, но могут проникать в сосудистую систему путем трансмуральной миграции через плотные эпителиальные соединения или с помощью независимого межклеточного механизма [3, 4].
Эпидемиология
Способ передачи
Период инкубации
Инкубационный период неизвестен, но, вероятно, от 2 до 4 дней.
Колонизация носоглотки - H. influenzae, особенно нетипируемым H. influenzae (NTHi) является обычным явлением [4–6]. Около 20% младенцев колонизируются в первый год жизни, и более половины детей колонизируются к пятилетнему возрасту [6]. Колонизация сохраняется на протяжении всей взрослой жизни [7].
Колонизация половых путей - NTHi может также колонизировать женские половые пути и вызывать локально инвазивные заболевания, такие как эндометрит, амнионит или абсцесс бартолиновой железы, с сопутствующей бактериемией или без нее [8].
Пик заболеваемости наиболее опасной формой Hib инфекции - менингита приходится на 6–12 месяцев. К этому возрасту ребенок перестает получать материнские антитела с грудным молоком, но еще неспособен вырабатывать собственные антитела.
Поскольку количество стран, использующих вакцины против Hib, увеличилось в период с 2000 по 2015 год, оценочное число случаев тяжелой Hib-инфекции в мире у детей младше 5 лет снизилось с более 8 миллионов до 340 000 [10,11]. Расчетная смертность от Hib-инфекции среди детей младше 5 лет также снизилась с 371 000 до менее 30 000.
По данным Всемирной организации здравоохранения широкое использование вакцин против гемофильной инфекции в развитых странах привело к почти полной элиминации заболеваний, вызванных данным возбудителем.
Клиническая картина
Cимптомы, течение
Клиническая картина [8]
• Менингит
Бактериемия
• Средний отит
• Эпиглоттит
• Внебольничная пневмония и эмпиема
• Перикардит
• Септический артрит
• Целлюлит, включая буккальный, пресептальный и орбитальный целлюлит.
Реже Hib может вызывать эндокардит, эндофтальмит, остеомиелит, перитонит и некротические инфекции мягких тканей [7].
Серотипы, не относящиеся к типу b, могут вызывать те же клинические синдромы, что и Hib [8-12].
Хотя инвазивные Hib-заболевания и серотипы, не относящиеся к типу b, встречаются редко, они связаны со значительной смертностью. По данным эпиднадзора в Соединенных Штатах с 2009 по 2015 год, летальность составила 4 процента для инвазивной Hib-инфекции и 11 процентов для инвазивных заболеваний, не относящихся к типу B. Нетипируемый H. influenzae - Нетипируемый H. influenzae (NTHi) обычно вызывает неинвазивные инфекции слизистых оболочек у детей старшего возраста и взрослых, обычно в результате местного распространения микроорганизмов из носоглотки [13, 14]. Это важная причина синусита, острого среднего отита, конъюнктивита, обострений хронической обструктивной болезни легких и внебольничной пневмонии у детей и взрослых.
В редких случаях NTHi вызывает местные инвазивные инфекции половых путей (например, эндометрит, амнионит, абсцесс бартолиновой железы) с сопутствующей бактериемией или без нее [15]. В период применения Hib конъюгированной вакцины NTHi также был идентифицирован как причина инвазивных инфекций (например, бактериемии, менингита, сепсиса), особенно у пожилых людей и младенцев [16]. Среди беременных женщин инфекция NTHi была связана с преждевременными родами, потерей плода и неонатальным сепсисом [17, 18].
Инвазивная инфекция NTHi связана с повышенной смертностью. По данным эпиднадзора в США с 2009 по 2015 год, летальность от инвазивной инфекции NTHi составила 16 процентов [14].
Диагностика
Жалобы и осмотр [19-23]
Гнойный менингит
Классически признаки менингита характерны для более старших детей. Иногда менингеальный синдром сочетается с другими проявлениями гемофильной инфекции (гнойный артрит, воспаление надгортанника, целлюлит). Примерно в 20% случаев развивается инфекционно-токсический шок. Заболевание протекает тяжело и нередко (до 5%) кончается летально. Даже при своевременно начатом лечении у 15–30 % переболевших сохраняются стойкие остаточные явления: нейросенсорная тугоухость, расстройства речи, умственная отсталость, задержка развития.
Симптоматика
Признаками ВЧД также могут быть:
Системные осложнения вследствие бактериемии:
• Оценка жизненно важных функций по АВСДЕ, выявление шока и/или повышенного внутричерепного давления (ВЧД).
Воспаление подкожной клетчатки (целлюлит) также чаще поражает детей первого года жизни, чаще локализуется на лице. Начинается нередко с картины ОРЗ (ринофарингит), затем появляется локальная отечность в области щеки или вокруг глазницы, кожа над припухлостью гиперемирована с цианотичным оттенком. Иногда заболевание осложняется воспалением среднего уха. Температура тела субфебрильная, симптомы общей интоксикации выражены слабо. У более старших детей воспаление подкожной клетчатки может локализоваться на конечностях.
Эпиглоттит (воспаление надгортанника) является очень тяжелой и стремительной формой гемофильной инфекции, в большинстве случаев сопровождается бактериемией. В отличие от менингита, пик заболеваемости которым приходится на первый год жизни, эпиглоттитом чаще болеют дети 2–7 лет. Начинается остро, характеризуется быстрым подъемом температуры тела, выраженной общей интоксикацией и картиной быстро прогрессирующего крупа, который в течение нескольких часов может привести к гибели ребенка от асфиксии. Классический симптом эпиглоттита – слюнотечение, обусловленное затруднением глотания. В течение нескольких часов нарастают признаки дыхательной недостаточности. Чтобы облегчить дыхание, больные принимают характерную позу – сидят, подавшись вперед и вытянув подбородок. Данная поза является опорно-диагностическим симптомом эпиглоттита. Лечение заключается в немедленной интубации трахеи и назначении антибактериальной терапии. При отсутствии своевременной медицинской помощи смертность составляет 5–10 %.
Гнойные артриты являются следствием гематогенного заноса гемофильной палочки, нередко сопровождаются остеомиелитом. Страдают преимущественно крупные суставы – коленный, голеностопный, тазобедренный и локтевой. Нередко сочетаются с менингитом. При поражении тазобедренного и плечевого суставов в 1/2 случаев требуется хирургическое лечение.
Скрытая (оккультная) бактериемия
Инфекции новорожденных
Другие инвазивные инфекции
Лабораторная диагностика [19-22]
Респираторные инфекции вызванные не капсулированными штаммами H.influenzae - этиологический диагноз обычно не требуется при неосложненных неинвазивных инфекциях дыхательных путей:
эмпирическая антимикробная терапия обычно включает активность против H. Influenzae;
выделение H. influenzae из образцов дыхательных путей не позволяет дифференцировать носительство от инфекции.
Инвазивные инфекции (HIB)
- При положительном посеве крови или подозрении на менингит проводят люмбальную пункцию.
- Проводят микроскопию с окраской по Грамму всех биологических жидкостей, которые могут содержать микроорганизм.
Не культуральные методы, направленные на выявление полисахаридного антигена Hib – бактерий:
- реакция латекс - агглютинации или - ПЦР анализ на ДНК Hib-бактерий в биологических образцах. Анализы на основе ПЦР обладают высокой чувствительностью и специфичностью, коротким временем проведения и могут использоваться у пациентов, получавших антибиотики до получения образца, но они не позволяют проводить тестирование на устойчивость к противомикробным препаратам.
Классические бактериологические методы (посев образцов) даже в условиях идеального применения способны обеспечить этиологическую расшифровку не более 40-50% случаев бактериального менингита, необходимо их дополнение некультуральными методами, с помощью которых можно обеспечить расшифровку до 60-80% (при применении реакции латекс-агглютинации) и до 80-90% (при ПЦР) [20, 21].
Основные методы лабораторной диагностики
Нейровизуализация - у некоторых детей целесообразно отложить ЛП на время выполнения нейровизуализации (обычно с помощью КТ), чтобы исключить внутричерепной процесс, при котором ЛП противопоказана.
Жизненно важно, чтобы противомикробная терапия не откладывалась, если есть противопоказания или невозможность выполнения ЛП или если ЛП откладывается из-за необходимости нейровизуализации. В любой из этих ситуаций следует как можно скорее провести посев крови и назначить эмпирические антибиотики до проведения нейровизуализации
Количество лейкоцитов в СМЖ при остром бактериальном менингите обычно > 1000 лейкоцитов / мкл, с преобладанием нейтрофилов.
Глюкоза и белок - уровень глюкозы в спинномозговой жидкости при бактериальном менингите низкий, обычно < 60 % от уровня глюкозы в крови - более чем в половине случаев глюкоза в спинномозговой жидкости составляет < 40 мг/дл. Белок в спинномозговой жидкости при остром бактериальном менингите обычно составляет от 100 до 500 мг/дл.
Жидкость в среднем ухе. У пациентов с сопутствующим средним отитом или мастоидитом можно провести тимпаноцентез для получения жидкости из среднего уха для окрашивания по Граму и посева, что может быть полезно, особенно если посев СМЖ отрицательный.
Лечение
Лечение [20-23]
Консервативное лечение
Общее руководство по клиническому ведению
Поддерживающие меры включают:
Перед введением антибиотиков по возможности следует сделать посев крови и как можно скорее провести ЛП при отсутствии противопоказаний.
Этиотропное лечение
Большинство инфекций, вызванных H. influenzae, лечат эмпирическим путем. Как правило, эмпирические схемы лечения включают антибиотик, применяемый для лечения H. influenzae. Антибиотики, обладающие активностью против H. influenzae, включают бета-лактамы (например, амоксициллин, амоксициллин-клавуланат или цефалоспорины второго и третьего поколения), фторхинолоны, макролиды и тетрациклины.
Амоксициллин-клавуланат является широко используемым вариантом эмпирического лечения локализованных и не угрожающих жизни инфекций, таких как средний отит, синусит и острые обострения хронической обструктивной болезни легких. У пациентов с системными инфекциями, такими как бактериемия или менингит, препаратом выбора является цефтриаксон.
• Для детей с известным или подозреваемым менингитом, вызванным H. influenzae, добавление дексаметазона во время начала приема антибиотиков (или непосредственно перед этим), по-видимому, улучшает результаты.
Устойчивость к ампициллину. Выработка бета-лактамазы, которая придает устойчивость к ампициллину, амоксициллину и пенициллину, является основным механизмом устойчивости к противомикробным препаратам среди типируемых и нетипируемых штаммов H. influenzae. Штаммы, продуцирующие бета-лактамазу, обычно остаются чувствительными к комбинированным ингибиторам бета-лактамаз (например, амоксициллин-клавуланат, ампициллин-сульбактам), цефалоспорины второго и третьего поколения и карбапенемы.
Ампициллин подходит только в том случае, если было доказано, что возбудитель инфекции является отрицательным по бета-лактамазе.
- Для детей с известным или подозреваемым менингитом, вызванным H. influenzae, добавление дексаметазона во время начала приема антибиотиков (или непосредственно перед этим), по-видимому, улучшает результаты.
Хирургическое лечение
Не требуется
Реабилитация
Не требуется
Госпитализация
Первичная медико-санитарная помощь детям оказывается в амбулаторных условиях.
Первичная доврачебная медико-санитарная помощь детям в амбулаторных условиях осуществляется в фельдшерско-акушерских пунктах, родильных домах, перинатальных центрах, медицинских кабинетах дошкольных и общеобразовательных учреждениях средним медицинским персоналом.
Профилактика
Высокоэффективные и безопасные вакцины Hib доступны уже почти 20 лет. Они почти полностью ликвидировали Hib-инфекцию как в развитых, так и в развивающихся странах, в которых они обычно используются. Эти вакцины также сокращают бессимптомное носоглоточное носительство и существенно защищают невакцинированных людей даже при умеренном охвате вакцинацией (40-50%).
Конъюгированные HIB-вакцины
В-клетки начинают продуцировать антитела к полисахариду ХИБ. Формирование адекватного иммунитета против ХИБ - инфекции наблюдается при введении 3 доз вакцин с PRP-антигеном, часто, параллельно с иммунизацией против дифтерии, столбняка и коклюша. Самая ранняя доза вводится в возрасте 6 недель и старше, а последующие дозы с интервалом 4-8 недель. Для детей старше года, которые ранее не получили прививку против ХИБ, достаточно введение одной дозы. ХИБ - вакцину не используют для детей старше 2 лет, т.к. в этом возрасте эта инфекция уже не представляет угрозу для жизни.
Плановая Hib иммунизация не повлияла на бремя заболеваний, вызванных другими серотипами и нетипируемыми H. influenzae (NTHi). NTHi являются основной причиной острого среднего отита, острого синусита, бронхита и внебольничной пневмонии, а также все более частой причиной инвазивных заболеваний. Разработка вакцин NTHi является активной областью исследований.
Побочные эффекты – Системная реакция (напр., лихорадка, раздражительность) после Hib иммунизации [23] наблюдается редко. Местные реакции (например, боль, покраснение и/или отек в месте инъекции) возникают примерно у 25% реципиентов. Местные реакции обычно умеренные и рассасываются в течение 24 часов. Частота побочных реакций при использовании Hib-содержащих комбинированных вакцин аналогична частоте при раздельном введении компонентных вакцин [28].
Введение – Объем каждой дозы конъюгированной Hib вакцины составляет 0,5 мл. Конъюгированную Hib вакцину вводят внутримышечно, обычно в переднелатеральную область бедра (для детей <3 лет) или дельтовидную мышцу для детей ≥ 3 лет).
Химиопрофилактика рекомендуется для всех бытовых контактов (включая нулевой случай) при следующих обстоятельствах [24]:
Контакты в детских или дошкольных учреждениях – проведение химиопрофилактики для контактов из детских или школьных учреждений после одного случая инвазивного Hib заболевания - вопрос спорный. Существующие эпидемиологические исследования пришли к различным выводам относительно риска среди контактов в детских учреждениях по сравнению с бытовыми контактами. Риск среди контактов в детских учреждениях оказался выше, по сравнению с общей популяцией, но ниже, чем среди бытовых/близких контактов [24].
Консультативный комитет AAP и CDC по практике иммунизации рекомендует химиопрофилактику для контактов из детских или дошкольных учреждений (независимо от возраста или вакцинного статуса), когда неиммунизированные или не полностью иммунизированные дети посещают подобные учреждения и когда в этих учреждениях в течение 60 дней произошло два или более случая инвазивного Hib заболевания среди детей, посещающих это учреждение [24, 25].
Профилактика должна быть начата в течение двух недель после начала заболевания и может быть начата в сочетании с лечением, если только пациент не лечится хлорамфениколом (одновременное введение рифампицина может снизить концентрацию хлорамфеникола в сыворотке крови) [[24, 25]].
Режим - рифампицин 20 мг/кг перорально (максимальная доза 600 мг) один раз в сутки в течение четырех дней является режимом выбора для химиопрофилактики Hib у лиц ≥1 месяца [24]. Доза рифампицина для детей <1 месяца не установлена; мы предлагаем 10 мг/кг один раз в день в течение четырех дней.
Другие препараты, кроме цефтриаксона и цефотаксима, которые можно использовать для лечения Hib-инфекций, такие как ампициллин, Цефаклор и ТМП-СМХ - неэффективны для химиопрофилактики, поскольку они ненадежно выводят Hib из носоглотки. Не рекомендуется использовать эти средства для антимикробной профилактики инвазивных Hib заболеваний.
Информация
Источники и литература
Информация
Ключевые слова:
Список использованных сокращений
NTHi нетипируемый H. influenzae
Состав рабочей группы
Адреса для переписки с рабочей группой:
Конфликт интересов
Данное клиническое руководство рассмотрено и рекомендовано: на заседании.
Все поправки, к представленным рекомендациям, будут опубликованы в соответствующих журналах. Любые комментарии и пожелания по содержанию руководства приветствуются.
Мониторинг внедрения клинического руководства (анализ использования, сбор информации по недостаткам и замечаниям), внесение дополнений и изменений осуществляет ЦРЗиМТ. Обновление версии руководства осуществляется по мере необходимости, по мере появления новых ключевых доказательств по диагностике и лечению столбняка, но не реже 1 раза в 5 лет.
Методология разработки клинических рекомендаций
Цель разработки данного клинического руководства
Целевые группы: врачи скорой неотложной помощи, врачи общей практики, терапевты, инфекционисты, невропатологи, анестезиологи, реаниматологи, хирурги, травматологи, организаторы здравоохранения.
Методы, использованные для сбора/селекции доказательств
Методы, использованные для оценки качества и силы доказательств
Шкала уровней доказательности и градации рекомендаций SIGN (Scottish Intercollegiate Guidelines Network)
1++
1+
1
2++
Высококачественные систематические обзоры исследований типа случай-контроль или когортных исследований, либо высококачественные исследования типа случай-контроль, либо когортные исследования с очень низким риском ошибки, предвзятости и с высокой вероятностью выявления связи с причиной
2+
Правильно проведенные исследования типа случай-контроль или когортные исследования с низким риском ошибки, предвзятости и с умеренной вероятностью выявления связи с причиной
2
3
Неаналитические исследования, например, сообщение о случае, серии случаев
4
Мнения экспертов
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Рейтинговая схема для оценки силы рекомендаций
Описание
А
По меньшей мере, один мета-анализ, систематический обзор, или РКИ, оцененные, как 1++ , напрямую применимые к целевой популяции и демонстрирующие устойчивость результатов или группа доказательств, включающая результаты исследований, оцененные, как 1+, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов
В
группа доказательств, включающая результаты исследовании, оцененные, как 2++, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов или экстраполированные доказательства из исследований, оцененных, как 1++ или 1+
С
группа доказательств, включающая результаты исследований оцененные, как 2+, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов; или экстраполированные доказательства из исследований, оцененных, как 2++
D
Доказательства уровня 3 или 4; или экстраполированные доказательства, из исследований, оцененных, как 2+
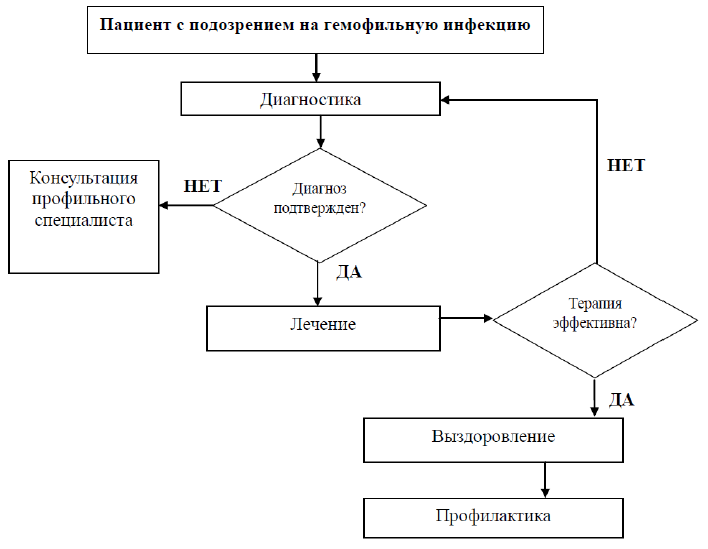
АЛГОРИТМ ВЕДЕНИЯ ГЕМОФИЛЬНОЙ ИНФЕКЦИИ
Информация для пациента
Гемофильная инфекция
Пути заражения
Ревакцинация
Начало вакцины до 6 мес: три прививки на первом году жизни
Одна прививка через 1 год после проведения первичной вакцинации
Начало вакцины с 7-12 мес: три прививки на первом году жизни
Одна прививка через 1 год после проведения первичной вакцинации
Дети старше 1 года прививаются однократно
Не требуется
После 5 лет иммунизация, как правило, не проводится
Не требуется
Экстренная вакцинация
Не проводится
Прикреплённые файлы
Внимание!
