Анестезиологическое обеспечение хирургических вмешательств
Анестезиологическое обеспечение хирургических вмешательств
 Версия: Клинические протоколы 2023 (Беларусь)
Версия: Клинические протоколы 2023 (Беларусь)
Общая информация
Краткое описание
КЛИНИЧЕСКИЙ ПРОТОКОЛ
ГЛАВА 1
2. Требования настоящего клинического протокола являются обязательными для юридических лиц и индивидуальных предпринимателей, осуществляющих медицинскую деятельность в порядке, установленном законодательством о здравоохранении.
3. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных Законом Республики Беларусь «О здравоохранении», а также следующие термины и их определения:
класс II – пациенты со слабыми или умеренными системными расстройствами, связанными или не связанными с предстоящим хирургическим вмешательством (легкие заболевания без существенных функциональных ограничений (ожирение (индекс массы тела (далее – ИМТ) >30), контролируемая артериальная гипертензия (далее – АГ)), курящие, беременные женщины);
класс III – пациенты с выраженными системными расстройствами, связанными или не связанными с предстоящим хирургическим вмешательством (одно или несколько заболеваний средней и тяжелой степени тяжести: плохо контролируемые сахарный диабет (далее – СД); АГ или хроническая обструктивная болезнь легких (далее – ХОБЛ); морбидное ожирение с ИМТ >40; активный гепатит, психические и поведенческие расстройства вследствие употребления алкогольных, слабоалкогольных напитков, пива, потребления наркотических средств, психотропных веществ, их аналогов, токсических или других одурманивающих веществ, имплантированный кардиостимулятор; умеренное снижение фракции выброса; пациенты с хронической почечной недостаточностью (далее – ХПН) и регулярным плановым диализом);
класс IV – пациенты с тяжелыми системными расстройствами, несущими угрозу жизни в связи с хирургическим вмешательством и (или) без него (перенесенные в течение трех месяцев острый инфаркт миокарда, острое нарушение мозгового кровообращения, транзиторная ишемическая атака, ишемия миокарда или тяжелая дисфункция клапанов, выраженное снижение фракции выброса, сепсис, синдром диссеминированного внутрисосудистого свертывания крови, ХПН без регулярного планового диализа);
класс V – умирающие пациенты с невысокой вероятностью выжить, у которых хирургическое вмешательство рассматривается в качестве последнего шанса (разрыв аневризмы брюшной или грудной аорты, массивная травма, внутричерепное кровоизлияние с масс-эффектом, мезотромбоз в сочетании с выраженной сердечной патологией, полиорганная дисфункция);
класс VI – умерший донор.
Диагностика
ГЛАВА 2
5. Общими принципами организации предоперационного осмотра пациента являются:
7. При предоперационном осмотре врачом-анестезиологом-реаниматологом оцениваются результаты лабораторных и инструментальных исследований, назначенных, в том числе, врачом-специалистом по результатам предварительного предоперационного осмотра.
Лабораторные и инструментальные исследования перед хирургическим вмешательством выполняются при наличии медицинских показаний к выполнению лабораторных и инструментальных исследований, зависящих от вида хирургического вмешательства и класса физического состояния пациента по ASA, установленных согласно приложению 5.
Общий анализ мочи перед хирургическим вмешательством назначается по медицинским показаниям. Возможно назначение общего анализа мочи с микроскопией осадка и бактериологическим исследованием (посев мочи на флору) в случаях, когда выявление инфекции мочевыводящих путей может служить основанием для отмены хирургического вмешательства или своевременного назначения этиотропной антибиотикотерапии.
Гликированный гемоглобин (далее – HbA1C) перед хирургическим вмешательством измеряется у пациентов с СД при отсутствии данных о его значении за последние 3 месяца.
Рентгенография органов грудной клетки перед хирургическим вмешательством проводится по медицинским показаниям, в том числе при наличии у пациента патологии органов дыхания или соответствующих клинических проявлений, декомпенсированной сердечно-сосудистой патологии.
Эхокардиография перед хирургическим вмешательством не проводится, за исключением наличия у пациента признаков или симптомов сердечной недостаточности или иных медицинских показаний.
Медицинские показания для выполнения отдельных лабораторных и инструментальных исследований установлены в перечне согласно приложению 6. Решение о необходимости выполнения дополнительного исследования при наличии медицинских показаний, не указанных в данном перечне, принимается индивидуально в каждом конкретном случае с учетом имеющейся или предполагаемой патологии у пациента, вида хирургического вмешательства и вида планируемой анестезии.
Срок давности лабораторных исследований не должен превышать 14 календарных дней, инструментальных исследований – 90 календарных дней. При необходимости исследования могут быть проведены повторно. Основанием для повторного выполнения лабораторных исследований может служить острое изменение состояния пациента (простудные заболевания, обострение хронической патологии и иные), произошедшее после забора биологического материала для исследования.
Предоперационное обследование пациентов с СД включает:
20. Для оценки риска и предупреждения легочной аспирации учитываются следующие факторы:
Наиболее распространенными причинами, предрасполагающими к аспирации, являются:
Лечение
21. Врач-анестезиолог-реаниматолог в процессе предоперационного осмотра пациента проводит психологическую подготовку пациента к хирургическому вмешательству, а также определяет необходимость и объем использования лекарственных препаратов, о чем делает соответствующую запись в протоколе осмотра врача-анестезиолога-реаниматолога.
22. Психологическая подготовка пациента к хирургическому вмешательству проводится с целью получить от пациента доверие и поддержку, а также вселить в него уверенность в благоприятном исходе предполагаемого анестезиологического пособия.
23. Проведение медикаментозной подготовки с целью облегчения анестезиологического пособия назначается для:
26. Наркотические анальгетики показаны при необходимости купирования болевого синдрома у пациента, при отсутствии болевого синдрома они могут вызвать дисфорию. Опиоиды назначаются для обеспечения анальгоседации (в сочетании с производными бензодиазепина) при проведении регионарных методик анестезии, установке инвазивного мониторинга или венозных линий, если эти манипуляции планируется выполнять у пациентов в сознании.
27. Блокаторы гистаминовых H2-рецепторов назначаются с целью снижения кислотности и уменьшения объема содержимого желудка при угрозе регургитации и легочной аспирации.
29. Противосудорожный лекарственный препарат габапентин может быть назначен для премедикации и седации пациентов, так как он снижает послеоперационное использование опиоидных анальгетиков для лечения болевого синдрома и обладает анксиолитическим эффектом. Наиболее частыми нежелательными реакциями могут быть головная боль и головокружение.
30. Пероральная премедикация ингибитором циклооксигеназы2 (далее – ЦОГ-2) целекоксибом1 (в дозе 400 мг) может быть назначена в предоперационный период для снижения болевого синдрома в раннем послеоперационном периоде. Применение данного лекарственного препарата ограничено нежелательными реакциями и медицинскими противопоказаниями (пептические язвы, бронхиальная астма, тяжелые заболевания сердца и почек, повышенная чувствительность к сульфаниламидам, нарушение свертываемости крови, беременность, болезнь Крона, язвенный колит).
32. Прием пищи прекращается пациентом за 6 часов до планового хирургического вмешательства. Интервал между последним приемом молока или молочных продуктов (кефир, сливки, ряженка и иные) и хирургическим вмешательством должен составлять не менее 6 часов. Прием прозрачных жидкостей (вода, негазированные безалкогольные напитки, соки без мякоти, чай, кофе без добавления молока, сливок) прекращается за 2 часа до хирургического вмешательства. Допускается прием лекарственных препаратов менее чем за 2 часа до хирургического вмешательства, при этом пациент может запить лекарственные препараты небольшим количеством воды (до 50 мл). При несоблюдении пациентом требований по приему пищи плановое хирургическое вмешательство отменяется и переносится на следующий день.
Для ускорения опорожнения желудка может быть назначен метоклопрамид (раствор для внутривенного введения 5 мг/мл) внутривенно за 1 час до начала хирургического вмешательства 10 мг.
Для предупреждения аспирации желудочного сока пациентам с факторами риска (ожирение, беременность, высокое внутрибрюшное давление, парез кишечника, низкий тонус пищеводного сфинктера, гастроэзофагеальный рефлюкс, замедленное высвобождение пищи из желудка) внутривенно назначаются блокаторы гистаминовых Н2-рецепторов: ранитидин (раствор для внутривенного введения 25 мг/мл) 2 мл в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно, или фамотидин (лиофилизированный порошок для приготовления раствора для внутривенного введения 20 мг) в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно или ингибиторы протонной помпы: омепразол (лиофилизированный порошок для приготовления раствора для внутривенного введения 40 мг) в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно, или пантопразол (лиофилизированный порошок для приготовления раствора для внутривенного введения 40 мг) в разведении раствором натрия хлорида 9 мг/мл до 20 мл внутривенно за 1 час хирургического вмешательства.
44. Во время проведения анестезии, в том числе в амбулаторных условиях, проводится контроль за ее течением и функциями организма пациента. Выделяются обязательный анестезиологический мониторинг, который проводится при любой анестезии, и дополнительный, который проводится по медицинским показаниям.
Обязательный анестезиологический мониторинг включает мониторирование следующих параметров:
После индукции анестезии и миоплегии (если она показана) проводится обеспечение проходимости верхних дыхательных путей (инсталляция ларингеальной маска либо интубация трахеи).
Индукция анестезии осуществляется следующими лекарственными препаратами: пропофол 2,5–2,5 мг/кг или тиопентал натрия 3–5 мг/кг, или кетамин 1–2 мг/кг, или мидазолам 0,15–0,2 мг/кг (0,3–0,35 мг/кг без премедикации), или этомидат, который вводится внутривенно в дозе 150–300 мкг/кг в течение 10–30 сек., при необходимости проводится повторное введение, не ранее чем через 4 минуты после предыдущего введения в дозе 150 мкг/кг, что увеличивает продолжительность наркоза до 10 минут. Максимальная разовая доза этомидата составляет 30 мг.
53. После индукции анестезии и миоплегии (если она показана) проводится обеспечение проходимости верхних дыхательных путей (инсталляция ларингеальной маски либо интубация трахеи).
57. Спинальная (субарахноидальная) анестезия и анальгезия выполняются врачом-анестезиологом-реаниматологом в операционной или манипуляционной, где необходимо наличие аппаратуры для проведения гемодинамического мониторинга, дыхательной аппаратуры, кислорода, дефибриллятора, ларингоскопа, инфузионных сред, а также лекарственных препаратов для проведения сердечно-легочной реанимации. Перед проведением регионарных методов обезболивания налаживается гемодинамический мониторинг, а также обеспечивается венозный доступ. Преинфузия используется только при наличии медицинских показаний.
При использовании для спинальной анестезии изобарических растворов обеспечивается непрерывное медицинское наблюдение за пациентом в течение минимум 2 часов после выполнения блокады.
Изобарические анестетики противопоказаны пациентам с повышенным внутрибрюшным давлением (беременные, пациенты с морбидным ожирением и иные).
Использование разных концентраций местных анестетиков позволяет добиться дифференцированного эпидурального блока: низкие концентрации местного анестетика обеспечивают развитие эпидуральной анальгезии, более высокие – анестезии и выраженного моторного блока.
При этом необходимо учитывать общую дозу местного анестетика во избежание системной токсической реакции, а также снижать дозу у пациентов старше 60 лет, беременных и ослабленных пациентов. Изделия медицинского назначения, медицинская техника и лекарственные препараты для лечения системной токсичности местных анестетиков должны быть готовы к применению.
Дозы эпидурально вводимого морфина для анальгезии установлены согласно приложению 19.
В асептических условиях при паравертебральной анестезии и нанальгезии проводятся пункция и катетеризация паравертебрального пространства. Идентификация паравертебрального пространства осуществляется методом утраты сопротивления по анатомическим ориентирам (техника использования анатомических ориентиров) или с использованием ультразвуковых исследований (далее – УЗИ) (УЗИ-ассистированных техник). Поверхностные анатомические ориентиры маркируются перед выполнением блокады. Для подтверждения правильного положения катетера используется аспирационная и гравитационная пробы. Для анестезии используется однократное или постоянное введение анестетика через паравертебральный катетер.
После проведения паравертебральной блокады на грудном уровне обязательно выполняется рентгенография органов грудной клетки через 2 часа после блокады (либо сразу после хирургического вмешательства, если его длительность превышает два часа).
При проведении УЗИ-ассистированных блокад, как правило, требуются меньшие объемы анестетиков. Необходимо учитывать общую дозу местного анестетика во избежание системной токсической реакции, а также снижать дозу у пациентов старше 60 лет и ослабленных пациентов.
При блокаде седалищного нерва применяются раствор для инъекций лидокаина 1–1,5 мг/мл 20–40 мл, раствор для инъекций бупивакаина изобарический 2,5–5 мг/мл 20–30 мл, раствор для инъекций ропивакаина изобарический 5–7,5 мг/мл 10–30 мл или раствор для инъекций левобупивакаина изобарический 2,5–5 мг/мл 20–30 мл. Эпинефрин в качестве добавки к местному анестетику при блокаде седалищного нерва не используется.
При блокаде поперечного пространства живота (TAP-блок) на каждую сторону применяется: раствор для инъекций бупивакаина изобарический 2,5 мг/мл раствор 20–30 мл, раствор для инъекций ропивакаина изобарический 5 мг/мл 20–30 мл или раствор для инъекций левобупивакаина изобарический 2,5 мг/мл 20–30 мл. Используется только в сочетании с общей анестезией.
При блокаде влагалища прямых мышц живота (RS-блок) на каждую сторону применяются: раствор для инъекций бупивакаина изобарический 2,5 мг/мл 10 мл, раствор для инъекций ропивакаина изобарический 5 мг/мл 10 мл или раствор для инъекций левобупивакаина изобарический 2,5 мг/мл 10 мл. Используется только в сочетании с общей анестезией.
При выполнении блокад бупивакаином его максимальная доза не должна превышать 150 мг в 4 часа и 400 мг в сутки.
75. Методами (способами), позволяющими снизить риск развития ПОТР являются:
76. Пациентам, которым планируется проведение общей анестезии, проводится медицинская профилактика ПОТР в соответствии с алгоритмом медицинской профилактики ПОТР, установленным согласно приложению 21.
Если медицинская профилактика ПОТР проводилась, при возникновении ПОТР используются лекарственные препараты из другой фармакологической группы, чем те, что использовались для медицинской профилактики. Если лекарственные препараты из других фармакологических групп недоступны, то возможно повторное введение антагонистов 5НТ3-рецепторов (если прошло более 6 часов с момента введения первой дозы) или лекарственных препаратов, производных бутирофенона – дроперидол.
78. Быстрая последовательная индукция – анестезиологическая техника, которая применяется у пациентов с высоким риском аспирации желудочного содержимого. Цель данной техники – снижение риска аспирации путем максимального уменьшения времени манипуляции, когда дыхательные пути не защищены (от начала индукции до постановки ЭТТ).
80. При проведении быстрой последовательной индукции необходимо иметь набор для проведения интубации трахеи, аспиратор с набором санационных катетеров, операционный стол с возможностью быстрого изменения положения пациента. Может быть рассмотрено предварительное введение пациенту лекарственных препаратов, снижающих объем и уменьшающих кислотность желудочного содержимого (Н2-блокаторы, ингибиторы протонной помпы, метоклопрамид, цитрат натрия). При наличии клинических и (или) инструментальных данных о повышенном объеме содержимого в желудке (>1,5 мл/кг) проводится опорожнение желудка при помощи зонда.
99. К трудным дыхательным путям относятся:
Пациентам, которым планируется проведение анестезиологического пособия или выполнение хирургического вмешательства на дыхательных путях, по возможности проводится комплексная оценка дыхательных путей по шкале «Москва-TD» по алгоритму, установленному согласно приложению 27, и рассчитывается ИТИ.
Врач-анестезиолог-реаниматолог подробно описывает состояние дыхательных путей, а также проблемы, которые возникли при обеспечении их проходимости, в медицинских документах.
Сочетание признаков предстоящей трудной интубации трахеи и трудной вентиляции легких или сочетание признаков предстоящей трудной интубации трахеи и «полного желудка» являются медицинскими показаниями к интубации трахеи с сохранением сознания пациента.
ИТИ (совокупность баллов по шкале «Москва-TD»): 0 – трудности не ожидаются; 1–2 – возможна трудная интубация; 3–4 – высокая вероятность трудной интубации; 5 и более – предстоит трудная интубация.
При наличии времени пациенту проводится преоксигенация 100 % кислородом со скоростью потока не менее 10 л/мин. в течение 3–5 минут или пациент делает 4 глубоких вдоха. В экстренной ситуации рассматривается возможность проведения кратковременной масочной вентиляции 100 % кислородом перед началом интубации (при этом учитывается опасность аспирации содержимым желудка).
Интубация трахеи выполняется под общей анестезией. Выбор лекарственного препарата для общей анестезии зависит от состояния гемодинамики пациента. Может проводиться стандартная или быстрая последовательная индукция.
Интубация трахеи без использования миорелаксантов затруднена и увеличивает вероятность осложнений.
У пациента в состоянии глубокой комы (3 балла по шкале ком Глазго) интубация трахеи выполняется без общей анестезии и миорелаксации.
Рот пациента открывается ножницеобразным движением пальцев или надавливанием на нижнюю челюсть, при этом следует избегать попадания губ в пространство между зубами и клинком.
Прямой клинок вводится в полость рта по средней линии, ориентируясь на язычок, затем на надгортанник. Кончик прямого клинка подводится непосредственно под надгортанник, затем поднимается надгортанник, избегая давления на верхние зубы пациента, и обнажается голосовая щель.
Оценка видимости голосовой щели по Кормак–Лихену при прямой ларингоскопии проводится согласно приложению 28.
При недостаточном обзоре голосовой щели возможно выполнение приема BURP (Backward, Upward, Rightward Pressure) – наружное смещение гортани пациента вниз, вперед и вправо. Выполнение интубации трахеи в этом случае может облегчить использование интубационного стилета, который изгибается необходимым образом вместе с ЭТТ для придания ей нужной формы, при этом дистальный край стилета не должен выходить за пределы ЭТТ.
При плохом обзоре голосовой щели (3 степень обзора по Кормак–Лихену) используется интродьюсер для интубации, по которому затем осуществляется введение ЭТТ.
Высокая вероятность трудной интубации – ИТИ 3–4 балла.
В случае успешной визуализации надгортанника выполняются попытки интубации трахеи (не более двух). Количество попыток интубации трахеи минимизируется, так как каждая последующая попытка приводит к нарастанию отека дыхательных путей и прогрессивному ухудшению визуализации анатомических ориентиров. Если интубация трахеи не удается после второй попытки, то от введения миорелаксантов следует отказаться. При неудаче интубации трахеи поддерживается проходимость дыхательных путей, обеспечивается подача 100 % кислорода на фоне сохраненного спонтанного дыхания, после чего медицинские работники дожидаются пробуждения пациента. Далее выполняется ФОИ, при их недоступности показана интубация трахеи в сознании через нос «вслепую» или ретроградная интубация трахеи в условиях локорегионарной анестезии дыхательных путей. Правильное положение ЭТТ подтверждается аускультативно и (по возможности) капнографически.
Как правило, ФОИ проводится с сохранением сознания у пациента. Вопрос о необходимости седации при ФОИ решается врачом-специалистом индивидуально, при этом важно не допустить потери контроля над дыхательными путями.
При проведении ФОИ трахеи в сознании под местной анестезией готовится к работе фибробронхоскоп, ЭТТ хорошо смазывается мазью с глюкокортикоидом: преднизолон (мазь для наружного применения 5 мг/г), или гидрокортизон (мазь для наружного применения 10 мг/г), назначаются холиноблокаторы: атропин (раствор для инъекций 1 мг/мл) в дозе 0,5 мг внутривенно. Если планируется назотрахеальная интубация, полость носа орошается раствором альфа-адреномиметика.
Пациент оксигенируется при помощи носовых катетеров, выполняется ФОИ. Если при продвижении ЭТТ в трахею она цепляется за черпаловидные хрящи, целесообразно немного повернуть ее против часовой стрелки на 90°.
После подтверждения правильного положения ЭТТ в трахее (визуально и при возможности капнографически) проводится индукция и налаживается ИВЛ.
план В – установка надгортанного устройства (ларингеальная маска и иные) и поддержание оксигенации пациента. Допустимо не более 3 попыток установки надгортанных устройств. В случае успешной установки вентиляция легких с подачей пациенту кислорода продолжается, а также рассматриваются альтернативные варианты действий: возможно ли разбудить пациента; возможно ли выполнить интубацию трахеи через надгортанное устройство; возможно ли отказаться от интубации трахеи; есть ли необходимость в хирургическом доступе к дыхательным путям. Если попытки установки надгортанного устройства окончились неудачей, врач-анестезиолог-реаниматолог объявляет о провале плана B и о переходе к плану C;
план D – показано немедленное выполнение хирургической или пункционной коникотомии, при этом предпочтительнее хирургическая коникотомия. По возможности хирургическая коникотомия выполняется хирургической бригадой.
Если перстне-щитовидная мембрана пальпируется:
После осуществления коникотомии и стабилизации состояния пациента решается вопрос о пробуждении пациента или начале хирургического вмешательства в зависимости от клинических проявлений.
Выделяют два вида экстубации трахеи:
Экстубация трахеи у пациентов с высоким риском развития осложнений: исходно трудные дыхательные пути, ухудшение состояния дыхательных путей в процессе проведения ИВЛ, ограниченный доступ к дыхательным путям и (или) наличие общих факторов риска (нарушение функции внешнего дыхания и сердечно-сосудистой системы, неврологические нарушения, гипо- или гипертермия, коагулопатия, нарушения КОС и электролитный дисбаланс).
При выполнении экстубации трахеи в кратчайшие сроки возобновляется подача кислорода пациенту. Недопустимо проводить так называемый «тест на спонтанное дыхание», когда пациент отсоединяется от дыхательного аппарата и дышит значительное время атмосферным воздухом через ЭТТ.
Проводится преоксигенация 100 % кислородом, положение пациента с приподнятой головой, особенно важно для пациентов с морбидным ожирением. Выполняется санация ротоглотки. С целью купирования рефлекторных реакций со стороны дыхательных путей на экстубацию трахеи возможно назначение наркотических анальгетиков, лидокаина, кетамина, β-блокаторов (с учетом состояния пациента).
После экстубации проводится тщательный мониторинг состояния пациента. Оптимальное положение пациента после экстубации трахеи – с приподнятым головным концом кровати. Обеспечивается подача кислорода с высоким потоком. При наличии возможности, используется мониторинг капнометрии (капнографии). Сразу после экстубации пациента не следует кормить (поить), так как защитная функция гортани может быть нарушена.
109. Набор для ведения пациентов с трудными дыхательными путями включает:
Лечение (амбулатория)
33. С целью сокращения сроков госпитализации для выполнения плановых хирургических вмешательств и диагностических мероприятий проведение предоперационных осмотров врачом-анестезиологом-реаниматологом, компенсация сопутствующей патологии и проведение дополнительных исследований могут осуществляться в амбулаторных условиях.
34. Врачи-специалисты организаций здравоохранения, ответственные за планирование хирургических вмешательств, направляют на предоперационный осмотр врачом-анестезиологом-реаниматологом в амбулаторных условиях пациентов:
36. Отбор пациентов для хирургических вмешательств в амбулаторных условиях проводится совместно врачом-хирургом и врачом-анестезиологом-реаниматологом. При хирургических вмешательствах в амбулаторных условиях медицинский осмотр врача-анестезиолога-реаниматолога в день хирургического вмешательства проводится непосредственно перед хирургическим вмешательством без предварительной консультации врача-анестезиолога-реаниматолога.
При оценке состояния пациента могут использоваться различные инструменты для скрининга анамнеза пациента и его физического состояния (бумажные или электронные анкеты, заполняемые пациентом самостоятельно или совместно с медицинским работником; интервью, проводимые медицинскими работниками, в том числе с применением телемедицинских технологий, и иные).
Проведение плановых хирургических вмешательств в амбулаторных условиях у беременных (особенно в 1 и 3 триместрах) не показано с целью ограничения риска выкидыша или преждевременных родов.
При планируемой продолжительности ингаляционной анестезии с сохраненным спонтанным дыханием более 30 минут или при планируемой продолжительности хирургического вмешательства под внутривенной анестезией с сохраненным спонтанным дыханием более 1 часа применяются оро-, назотрахеальная интубация или установка ларингеальной маски.
Периферические блокады выполняются только под ультразвуковой навигацией и (или) с использованием нейростимулятора. Методики регионарной анестезии, сопряженные с риском скрытых осложнений, не показаны. Показана инфильтрация раны местным анестетиком врачом-хирургом, если не выполнялись регионарные блокады.
Спинальная и эпидуральная анестезии в амбулаторных условиях не показаны.
42. Для выписки состояние пациента, которому проводилась анестезия, должно соответствовать перечисленным критериям:
Лечение (стационар)
Сроки послеоперационного медицинского наблюдения составляют:
Медицинское наблюдение за пациентом производится в специально оборудованных палатах пробуждения или при их отсутствии в палатах отделения анестезиологии и реанимации (при нестабильном состоянии пациента). При стабильности состояния, не требующем респираторной и гемодинамической поддержки, медицинское наблюдение за пациентом может проводиться в палатах профильных отделений.
Пациент в палате пробуждения (палате отделения анестезиологии и реанимации) располагается на медицинской кровати либо на каталке для перевозки пациента с возможностью изменения положения головного конца медицинской кровати либо каталки, оснащенных боковыми ограничителями.
При поступлении пациента из операционной в палату пробуждения (палату отделения анестезиологии и реанимации) и непосредственно перед переводом пациента из палаты пробуждения (палаты отделения анестезиологии и реанимации) врач-анестезиолог-реаниматолог отражает данные о состоянии пациента в протоколе анестезии.
Перевод пациента в общее отделение допускается в случае, если по модифицированной шкале Альдретта состояние пациента оценивается в 9 или 10 баллов, и выраженность болевого синдрома (по ВАШ или ПЦШ от 0 до 10 баллов) составляет 4 балла или менее.
Оценка интенсивности боли должна быть проспективной, проводится через определенные промежутки времени. Выраженность болевого синдрома определяется в состоянии покоя или при мобилизации (массаж и лечебная гимнастика, кашель, первый подъем с постели).
Ступенчатая схема состоит из:
При возникновении сильной послеоперационной боли или прорывных болей при онкологических заболеваниях терапия начинается с инвазивного введения сильных опиоидных анальгетиков (ступень IIIb) с целью купирования острой боли и предотвращения формирования хронического болевого синдрома. Дальнейшая терапия может быть осуществлена без применения сильных опиоидных анальгетиков или с дальнейшим введением сильных опиатов.
Медицинскими показаниями к применению фентанила являются: хронические боли, стабильные, интенсивные, устойчивые к другим опиоидным анальгетикам.
Медицинскими противопоказаниями к применению фентанила являются: установленная аллергия к фентанилу или силиконовым составляющим пластыря; декомпенсированная дыхательная недостаточность; грудное вскармливание.
При приеме фентанила следует избегать сочетания с приемом агонистов-антагонистов или частичных агонистов.
В интраоперационном периоде уснувшему пациенту вводится первый болюс кетамина (из-за риска развития психотических расстройств). После вводного наркоза до разреза вводится болюс 0,125–0,25 мг/кг, затем осуществляется продленное введение со скоростью 0,125–0,25 мг/кг/ч, если хирургическое вмешательство длится более 2 ч. Введение прекращается за 30 минут до окончания анестезии.
Нежелательными реакциями при приеме габапентина являются: сонливость, атаксия, головокружение, повышенная возбудимость, бессонница, нистагм, парестезии, тревожное возбуждение, астения, головные боли, тошнота, рвота, редко нарушения со стороны печени (цитолитические и холестатические реакции).
Режим дозирования: 600–1200 мг однократно за 2 ч до начала хирургического вмешательства вместо обычного анксиолитического лекарственного препарата либо в комбинации с ним. В послеоперационном периоде: 300–3600 мг/сутки (в среднем – 1200 мг/сутки) в 2–3 приема при лечении нейропатической боли и для послеоперационного обезболивания.
При почечной недостаточности применяются сильные опиоиды, на элиминацию которых нарушение функции почек оказывает меньшее влияние: фентанил, суфентанил6. Также предпочтительны методики местной и регионарной анальгезии.
При боли и тяжелой печеночной недостаточности противопоказаны: НПВП (усиление риска геморрагических осложнений и риска развития острой почечной недостаточности); парацетамол.
Предпочтение следует отдавать методикам местной и регионарной анальгезии (если это позволяет состояние системы гемостаза).
Информация
Источники и литература
Информация
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
Об утверждении клинического протокола
ПОСТАНОВЛЯЕТ:
2. Настоящее постановление вступает в силу после его официального опубликования.
СОГЛАСОВАНО
Форма
1. Фамилия, собственное имя, отчество (если таковое имеется)
Факторы риска развития сердечно-сосудистых осложнений8

Схема подбора оптимальной медикаментозной терапии


Схема коррекции приема лекарственных препаратов в периоперационном периоде



Медицинские показания к выполнению лабораторных и инструментальных исследований, зависящих от вида хирургического вмешательства и класса физического состояния пациента по ASA9

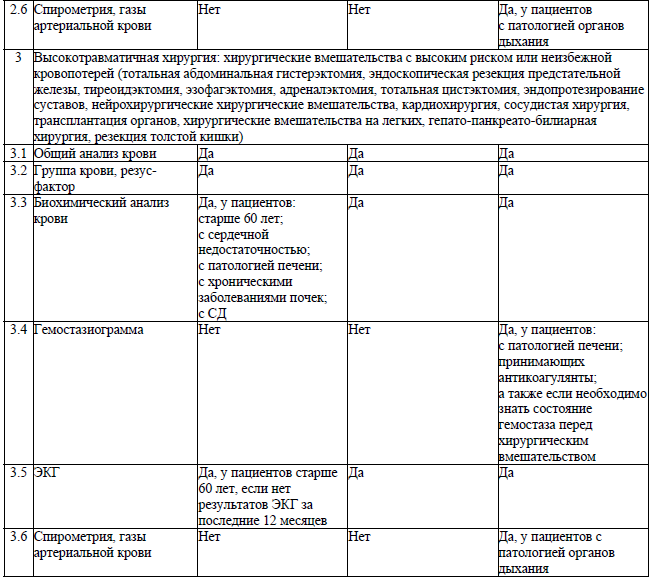
Приложение 6
Перечень медицинских показаний для выполнения отдельных лабораторных и инструментальных исследований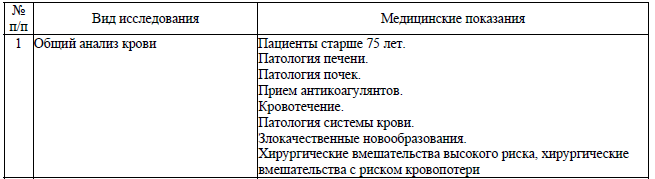

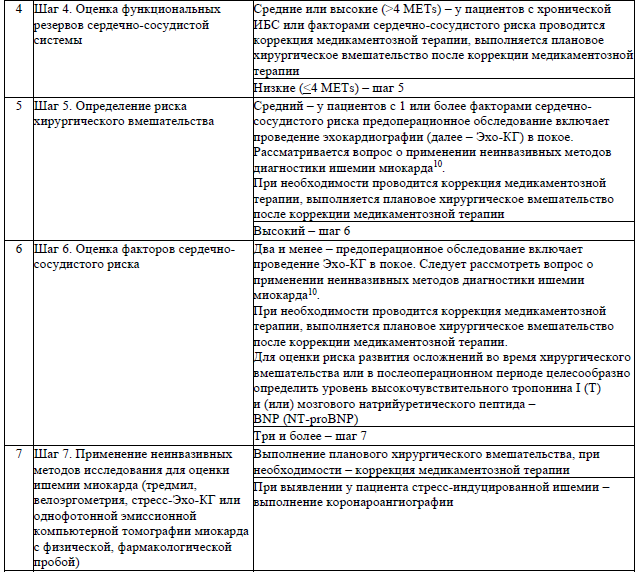
Алгоритм оценки сердечно-сосудистого риска, коррекции медикаментозной терапии и определения необходимости применения дополнительных методов обследования
Приложение 8
Шкала оценки риска инсульта и системной тромбоэмболии у пациентов с фибрилляцией предсердий CHA2DS2-VASc11

Приложение 9
Функциональные резервы
Перечень рисков при хирургических вмешательствах


Шкала STOP-BANG12
Алгоритм ведения пациента с СД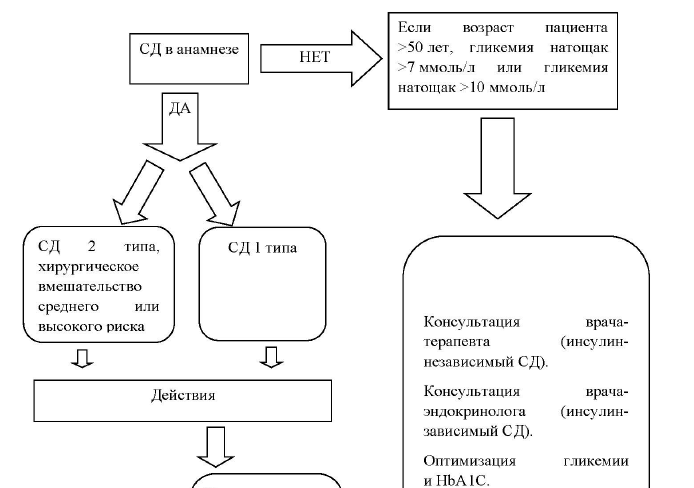

Перечень лекарственных препаратов для премедикации

Приложение 14
Перечень медицинской техники и изделий медицинского назначения, необходимых для оказания медицинской помощи пациентам с хирургическими заболеваниями для выполнения хирургических вмешательств и манипуляций с анестезиологическим пособием в амбулаторных условиях
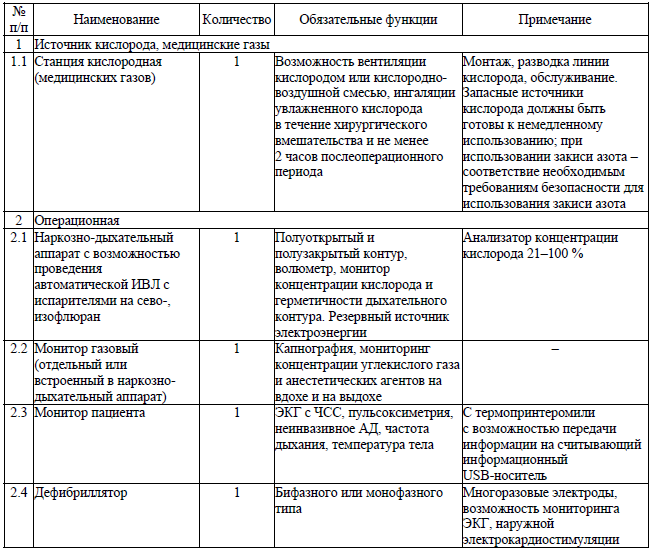


Модифицированная шкала Альдретта14
Перечень местных анестетиков для спинальной анестезии

Перечень местных анестетиков для эпидуральной анестезии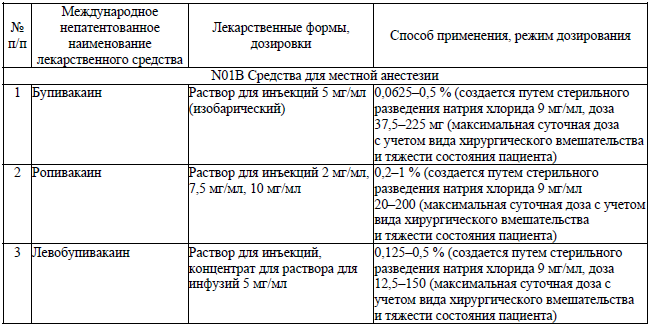
Области хирургических вмешательств, сегментарные границы блокады, оптимальный уровень установки кончика катетера в эпидуральном пространстве и минимальные объемы местного анестетика при комбинированной общей и эпидуральной анестезии

Дозы эпидурально вводимого морфина (раствор для эпидурального и интратекального введения 1 мг/мл) для анальгезии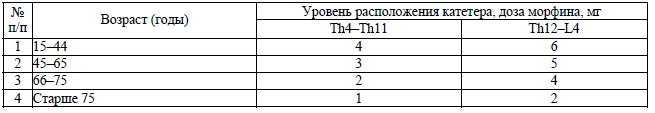
Факторы риска ПОТР
Алгоритм медицинской профилактики ПОТР
Перечень лекарственных препаратов, используемых для медицинской профилактики ПОТР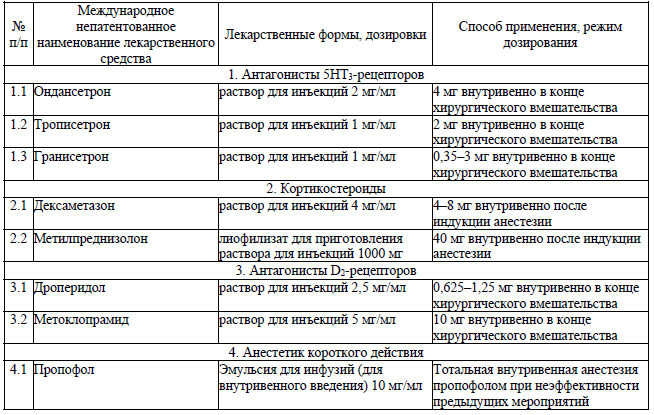
Общий алгоритм действий при неожиданно трудной интубации

Критерии оценки боли невербальных пациентов15

Приложение 25
Перечень ненаркотических анальгетиков16
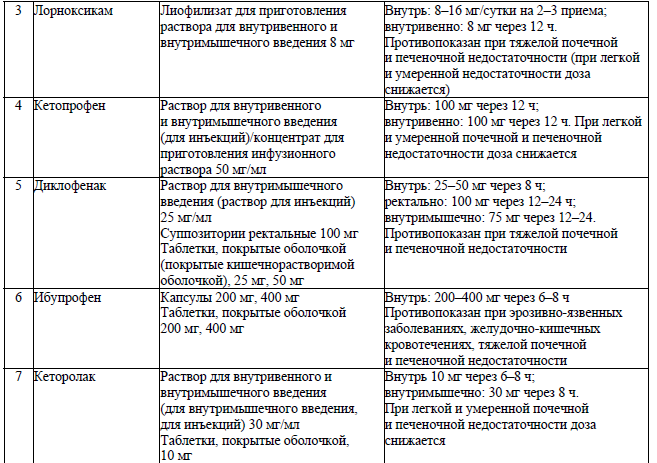

Приложение 26
Режим дозирования лекарственных препаратов при тяжелой почечной недостаточности

Алгоритм комплексной оценки дыхательных путей по шкале «Москва-TD»17
Оценка видимости голосовой щели по шкале Кормак–Лихена при прямой ларингоскопии18
Прикреплённые файлы
Внимание!
